6月2日讯 5月31日,普利制药发布公告称,公司于近日收到FDA签发的注射用比伐芦定仿制药上市批准通知。该产品属于公司共线生产的品种之一,数据显示,早前公司已拿下7个产品的ANDA文号,对公司拓展美国市场带来积极影响。
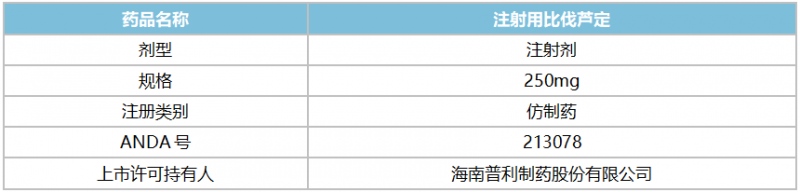
表1:普利制药获批产品信息
来源:公司公告
图1:国内市场上获得注射用比伐芦定生产批文的企业情况
来源:米内网一键检索
注射用比伐芦定是一种人工合成的抗凝血药物,2020年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端销售额超5亿元,海南普利制药的4类仿制上市申请于2020年9月获批并视同过评,目前国内市场上有7家药企获得该产品的生产批文(含1家原研进口)。
普利制药在公告中提到,公司的注射用比伐芦定属于共线生产品种,在2020年12月获得FDA的暂时批准,目前美国原研产品还在专利保护期内,专利期至2029年1月27日。
普利制药于2021年1月向FDA递交了PIV专利(与所申请仿制药相关的专利是无效的或仿制药不侵权)声明,同时也向原研注射用比伐芦定上市许可持有人和专利持有人发起专利挑战,原研公司在收到通知后的45天内未发起任何对普利制药注射用比伐芦定专利挑战的诉讼,即公司注射用比伐芦定ANDA挑战专利成功,随后公司向FDA通报上述进展并提交注射用比伐芦定仿制药最终上市批准的申请,近日公司收到FDA的上市批准通知,标志着公司具备了在美国销售注射用比伐芦定的资格。
表2:普利制药早前已获得的ANDA文号情况
来源:米内网全球上市药物数据库
据米内网数据显示,早前普利制药已获得了7个产品的ANDA文号,本次注射用比伐芦定获批,有助于提升公司在美国市场的销售业绩。
来源:公司公告、米内网数据库